淀粉样蛋白纤维的异常沉积是阿尔兹海默病、帕金森病、渐冻症等神经退行性疾病的核心病理标志物,也是实现这些疾病早期诊断和治疗的关键靶点。然而,有别于蛋白的天然构象,淀粉样蛋白聚集具有独特的结构多态性。也就是说,同一病理蛋白在不同条件下可能形成结构迥异的淀粉样聚集(amyloid polymorphs)。这些polymorphs具有不同的病理毒性,与不同的疾病亚型相关,为开发特异性识别特定polymorph的化学小分子PET探针及抑制剂带来了挑战。
近日,中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪课题组在《美国国家科学院院刊》(PNAS)上发表了题为Binding adaptability of chemical ligands to polymorphicα-synuclein amyloid fibrils的研究成果。以既往成果为基础,该研究分析了不同化学小分子与帕金森病关键病理蛋白α-突触核蛋白(α-syn)形成的不同amyloid polymorphs的结合位点与模式,揭示了小分子在识别与结合不同polymorphs时的高度可塑性。该成果拓展和完善了化学分子与淀粉样聚集的互作理论,并展现了病理蛋白聚集纤维的分子探针设计、研发以及其在临床应用中的潜力。
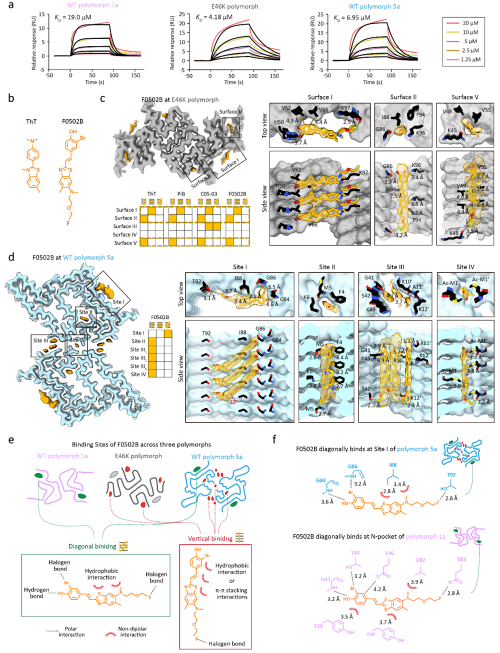
该研究分析了7种不同骨架的小分子与携带E46K突变的α-syn淀粉样聚集的结合特性,并将其与对野生型α-syn形成的polymorph 1a的结合特性进行了对比。利用表面等离子共振技术,研究测定了这些小分子对E46Kpolymorph的亲和力,并观察到它们对两种α-syn polymorphs展现出相似的亲和力。进而,研究采用冷冻电镜三维螺旋重构技术对小分子-E46K polymorph复合物进行结构解析,揭示了小分子在不同polymorphs中的具体结合位点和结合模式。研究发现,与天然蛋白质的三维结合口袋相比,淀粉样聚集的二维管状结合界面空间限制较小,为小分子提供了更多的结合自由度。这一特点使得小分子能够通过不同的取向与不同的结合位点相互作用,从而实现对不同amyloid polymorphs的识别和可塑性结合。
进一步,研究发现,通过改变小分子的骨架和官能团,可以对其结合可塑性进行调节。这丰富了科学家对小分子与淀粉样蛋白聚集互作机制的认识,并为设计具有高亲和力和高选择性的分子探针奠定了结构基础和化学基础。
该工作探讨了化学分子对病理蛋白聚集体不同polymorphs的结合特性,揭示了小分子在识别与结合不同polymorphs时的高度可塑性与适应性。该成果拓展了研究人员对小分子-淀粉样蛋白聚集体互作机制的认知,为研发淀粉样蛋白聚集特异性PET探针带来了新思考,并为开发神经退行性疾病的精准分子诊断工具奠定了基础。
研究工作得到国家自然科学基金委员会、中国科学院、上海市科学技术委员会的支持。
上海有机所提出化学分子识别病理蛋白聚集可塑性新观点